Fette - chemisch betrachtet
1In Suppen schwimmen die Fett- augen stets oben, sie vermischen sich nicht mit dem Wasser. Zwei wichtige Eigenschaften von Fetten lassen sich aus dieser Beobachtung erschlieβen: Fette besitzen eine geringere Dichte als Wasser und sie sind wasserunlöslisch (hydrophob). In Heptan, einem unpolaren Lösungsmittel, lösen sie sich hingegen gut. Fett-Moleküle müssen also unpolar sein.

2Ein Blick auf das Verpackungsetikett zeigt, dass auch Milch Fett enthält. Unter dem Mikroskop erkkennt man gut die kleinen Fetttröpfchen in der wässerigen Flüssigkeit. Die fein verteilten Fetttropfen und das Wasser bilden eine Emulsion. Emulsionen entmischen sich jedoch wieder. Bei der Milch verhindern Eiweiβ-Moleküle die Entmischung. Solche Stoffe nennt man Emulgatoren. Die Eiweiβ-Moleküle umhüllen die kleinen Fetttröpfchen und wirken so als Vermittler zwischen den unpolaren Fetttröpfchen und dem polaren Wasser.
3Fette und Öle. Nahrungsfette unterscheiden sich in der Konsistenz. Manche sind bei Raumtemperatur fest, andere streichbar, viele sind flüssig. Flüssige Fette werden als Öle bezeichnet. Fette eignen sich gut zum Garen von Speisen, weil man so höheren Temperaturen erreichen kann als mit Wasser. Oberhalb von 300 ºC können sich Fette jedoch an der Luft selbst entzünden. Fettbrände dürfen keinesfalls mit Wasser gelöscht werden, denn das Wasser sinkt wegen seiner höhere Dichte im Öl ab und verdampft dann sofort. Brennendes Fett wird nach allen Seite geschleudert. Fettbrende löscht man daher durch abdecken.

4Bau eines Fett-Moleküls. Fett- Moleküle bilden sich bei der Reaktion des dreiwertigen Alcohol Glycerin mit Fettsäuren. Fette gehören also zur Stoffklasse der Ester. Ein Glycerin-Molekül kann mit drei gleichartigen Fettsäuren- Moleküle mit zwei oder drei verschiedenen Fettsäure-Resten. Fette sind also Gemische verschiede- ner Glyserinester.
5Bei der Bildung von Fett-Molekülen werden Wasser-Moleküle abgespalten. Man spricht von einer Kondesationsreaktion.
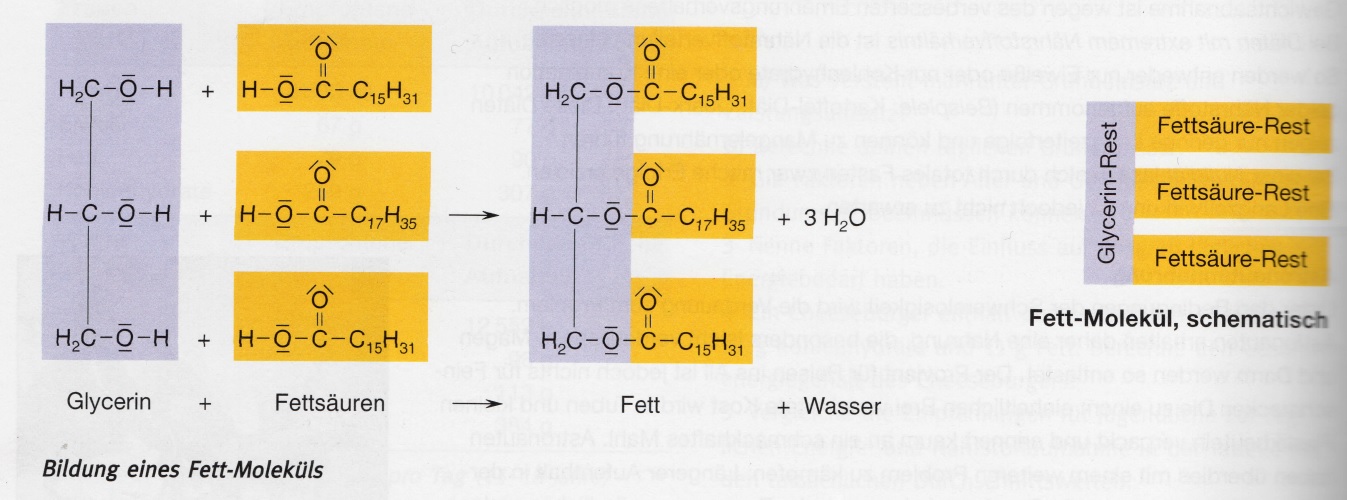
6Behandelt man Fette mit heiβem Wasserdampf, so bilden sich wieder Glycerin und Fettsäuren. Eine solche Molekülspaltung durch Reaktion mit Wasser ist eine Hydrolysereaktion
7Fette können auch durch Kochen mit Natronlauge zerlegt werden. Hierbei entstehen neben Glycerin die Natrium-Salze der Fettsäuren, die Seifen. Die Fettspaltung mit Laugen bezeichnet man daher auch als Verseifung.
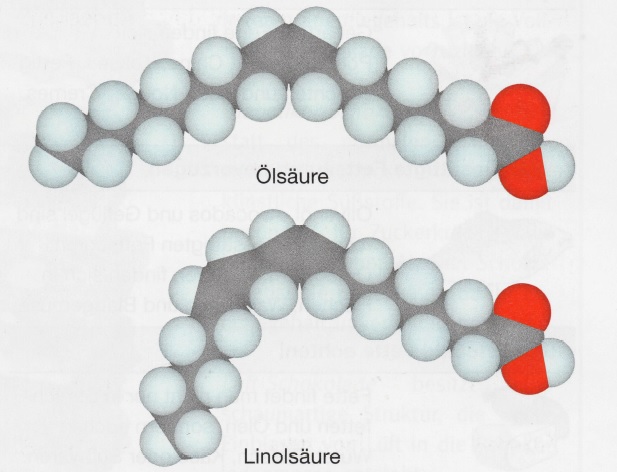
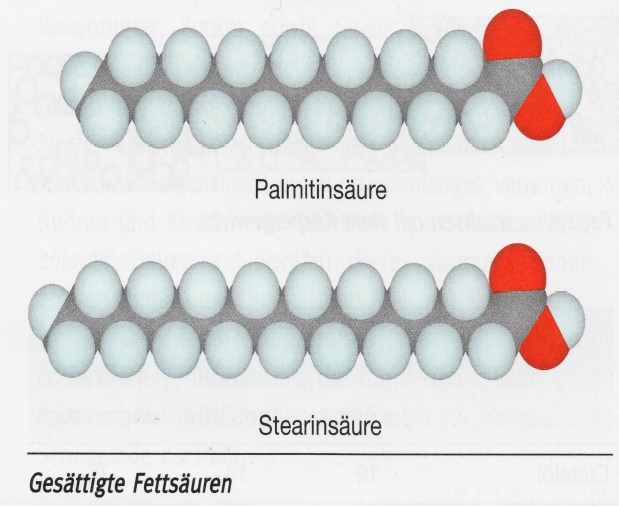
8Fettsäuren. Die Fetten gebundenen Fettsäuren sind meist langkettig und erhalten stets eine gerade Anzahl an Kohlenstoff- Atomen. Besonders häufig sind die Palmitinsäure mit 16 C-Atomen Stearinsäure mit 18 C-Atomen im Molekül. Diese gesättigen Fettsäuren sind bei Raumtemperatur fest. Daneben treten in Fetten auch ungesättige Fettsäuren auf. Ihre Moleküle enthalten eine oder mehrere C=C- Zweifachbindungen. Die Ölsäure ist eine einfach ungesättigte Fettsäure, die Linolsäure gehört zu den mehrfach ungesät - tigten Fettsäuren.
9Eigenschaften der Fette. Die in der Natur vorkommenden Fette sind keine Reinstoffe sondern stets Gemische verschiedener Ester, die sich in den Fettsäuren-Resten unterscheiden. Fette haben daher keine bestimmte Schmelztempe- ratur. Sie werden beim Erwärme allmählich weich. Gesättigte Fettsäure-Reste erhöhen die Schmelztemperatur des Fettes. Fette mit einem hohen Anteil an Stearingsäure-Resten und Palmitinsäure-Resten sind daher bei Raumtemperatur fest.
10Öle enthalten einen höheren Anteil an ungesättigen Fettsäure- Resten. Dabei sind die beiden Kohlenwasserstoff-Reste an den C=C- Zweifachbindungen immer zu gleichen Seite hin gerichtet: Es liegt eine cis-Anordnung vor. Die Kohlenwasserstoff-Kette ist dadurch geknickt. Ungesättigte Fettsäuren bilden im Vergleich zu gesättigten-Fettsäuren gleicher Kettenlänge, daher nicht so leicht eine geordnete Struktur. Öle sind deshalb beim Raumtemperatur flüssig.
11Die C=C Zweifachbindungen in ungesättigten Verbindungen können durch addition von Brom oder lod nachgewissen werden. In der Lebensmittelchemie gigt man durch die lodzahl an, wie viel Gramm lod von 100 Gramm eines Fettes gebunden werden.
Fette sind Glycerinrester, die bei der Reaktion von Glycerin mit Fettsäuren entstehen. Die Fettsäure-Reste können gesättigt oder ungesättigt sein. Die Konsistenz der Fette wird durch die Fettsäure-Reste bestimmt.
| gesättigte Fettsäuren | Beispiele | Vorkommen |
|---|---|---|
| kurzkettig | Buttersäure C3H7COOH | Butter |
| mittelkettig | Caprylsäure C7H15COOH | Kokosfett |
| langkettig | Palmitinsäure C15H31COOH Stearinsäure C17H35COOH | in allen Nahrunsfetten |
| ungestättige Fettsäure | Beispiele | Vorkommen |
|---|---|---|
| mit 1C=C Zweifachbindungen | Ölsäure C17H33COOH | Olivenöl, Margarine |
| mit 2 C=C Zweifachbindungen | Linolsäure C17H31COOH | Maiskeimöl, Sojaöl |
| mit 3 C=C Zweifachbindungen | Linolensäure C17H29COOH | Leinöl |