Immagini tridimensionali ad alta risoluzione di interi organi: la rivoluzione nello studio del sistema nervoso
di Stefania Averaimo
Esercizio 1 Prelettura.
- Leggi velocemente l’abstract, cioè l’introduzione del testo facendo attenzione ai seguenti termini: “Opacità dei tessuti”, “Tecnica 3DISCO” che sono chiave per la comprensione della proposta che fa l’autrice.
- Fai attenzione al glosario técnico introdotto dall’autrice nel primo box. Puoi dire con che criterio sono ordinate le diverse tecniche?
tecniche?Alfabetico
- Nel secondo box, sono introdotte le diverse tecniche di imaging. Cerca di capire le differenze tra ciascuna per poter mettere in relazione gli elementi del seguente esercizio
NOTA: L’italiano attuale ha una tendenza molto forte ad includere parole dell’inglese senza nemmeno mettere virgolette oppure indicarle in corsivo. In questo testo ci sono due molto evidenti:
Box: che si riferisce in questo caso alle tabelle con fondo grigio dove si presentano il glosario técnico e le tecniche di imaging.
Imaging: è la parola che si usa parlare della creazione di immagini, representazioni visive di carattere scientifico di cose che normalmente sono invisibili e che servono per lo studio o dei tessuti.
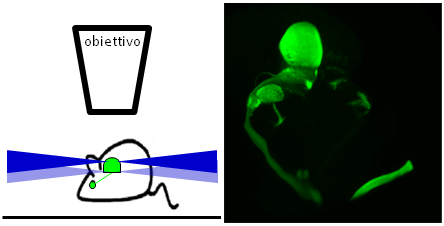
Nei mammiferi, l’opacità dei tessuti adulti (come ad esempio il cervello di un roditore adulto) impedisce l’acquisizione di immagini di interi organi. L’unico modo per studiare questi sistemi è il sezionamento e l’osservazione al microscopio delle singole sezioni. Questa è una forte limitazione alla comprensione dei meccanismi di comunicazione nel sistema nervoso. Attraverso una nuova tecnica, chiamata 3DISCO, è possibile rendere il tessuto trasparente, permettendo la penetrazione da parte della luce. Usando 3DISCO, non è più necessario sezionare il tessuto, e l’acquisizione di immagini può essere fatta sull’organo intero, permettendo un’analisi rapida e dettagliata di complesse e delicate strutture come le connessioni neuronali.
Lo studio della complessa organizzazione del sistema nervoso nella sua totalità ha da sempre stimolato la curiosità di molti ricercatori, senza però riuscire finora a dare risultati davvero soddisfacenti. Infatti, l’utilizzo di tecniche di analisi in vitro, seppure molto utile, non può rispondere a tutte le domande relative allo studio del sistema nervoso, il cui corretto funzionamento dipende da una precisa interazione tra le diverse cellule che può essere analizzata correttamente solo in vivo. (per maggiori informazioni, vi invitiamo a leggere anche l’articolo AIRInforma dedicato alla sperimentazione animale [1]). Ad esempio, è stato ipotizzato un difetto nello sviluppo del sistema nervoso e delle connessioni neuronali alla base di disturbi come schizofrenia e autismo [2-3]. Gli embrioni di molte specie invertebrate comunemente utilizzati in laboratorio come organismi modello, quali il moscerino della frutta (Drosophila melanogaster), il verme nematode (Caenorhabditis elegans) o persino alcuni vertebrati come il pesce zebra (Danio rerio) o la rana (Xenopus laevis), sono trasparenti, per cui è semplice osservare i neuroni di questi organismi, le loro connessioni e le loro ramificazioni. Al contrario, il cervello dei mammiferi è piuttosto opaco. Il tessuto dei mammiferi contiene infatti diverse componenti cellulari ed extracellulari (membrane, citoplasma , organelli , proteine della matrice extracellulare,…): quando guardiamo questi componenti con un microscopio, la luce viene assorbita e l’energia della luce incidente si disperde quindi all’interno del tessuto. Le immagini che otterremo avranno quindi una risoluzione molto bassa, rendendo impossibile l’analisi di tessuti più spessi, tipici degli organismi adulti. Questo ci costringe a limitare lo studio di organi interi esclusivamente ad embrioni nei primi stadi di sviluppo, quando il tessuto è ancora sufficientemente trasparente per poter essere visualizzato direttamente.
Le tecniche normalmente utilizzate in campo medico (come ad esempio la Risonanza Magnetica per Immagini, anche detta MRI, una tecnica di indagine medica comunemente utilizzata in diagnostica, vedi Glossario per maggiori dettagli), pur non essendo invasive, non hanno una risoluzione sufficiente per in dettaglio le connessioni neuronali. Inoltre, l’utilizzo di tecniche di istologia (come ad esempio il sezionamento del tessuto, l’analisi al microscopio e il successivo allineamento delle immagini acquisite da sezioni successive), non solo richiedono molto tempo, ma sono anche soggette ad errori durante il preciso allineamento di varie sezioni successive.
Negli ultimi decenni una sofisticata tecnica di microscopia chiamata Microscopia a due fotoni (vedi Box per dettagli) è stata largamente utilizzata al fine di acquisire immagini in vivo, su piccole porzioni di tessuto e resta ad oggi uno dei metodi privilegiati per analizzare la dinamica di alcune strutture delle cellule a livello microscopico. Nonostante questo, acquisire immagini ad alta risoluzione senza tagliare il tessuto è stato finora impossibile, e solo qualche anno fa la ricerca ha fornito finalmente una risposta utile allo studio delle complicate connessioni neuronali nel loro insieme, grazie ad un trattamento del tessuto semplice e rapido.
Glossario Tecnico
Assone: porzione del neurone lunga e sottile che ha origine dal corpo cellulare, deputata al trasporto di informazioni verso altre cellule sottoforma di impulsi elettrici.
Corpo cellulare: porzione centrale di un neurone in cui è presente il nucleo ed altre strutture necessarie alla sopravvivenza del neurone stesso.
CTB: subunità B della tossina colerica. Questa proteina, priva di ogni patogenicità, e coniugata ad una molecola fluorescente, viene attivamente spostata dai sistemi di trasporto della cellula, dal corpo cellulare di un neurone verso l’assone. Dopo la fissazione del campione la fluorescenza permette di seguire le proiezioni neuronali.
Fissazione di un campione: tecnica in cui i campioni vengono trattati con una sostanza (e.g. paraformaldeide) che, creando legami chimici tra le diverse proteine all’interno di un tessuto, lo mantiene intatto. Il tessuto, pur non essendo più vivo, mantiene le sue caratteristiche morfologiche.
GFP, RFP: proteina fluorescente verde (GFP, green fluorescent protein) o rossa (RFP, red fluorescent protein). Sono proteine che quando vengono colpite da un fascio di luce ad una certa lunghezza d’onda, restituiscono un segnale luminoso ad una determinata lunghezza d’onda che puo può essere raccolto da un microscopio.
Retina: porzione dell’occhio contenente le cellule preposte alla percezione del segnale luminoso, la trasformazione in segnale chimico che le cellule possano comprendere, e il trasporto al cervello dove verrà elaborato.
Topo transgenico: topo in cui è stato inserito all’interno del suo genoma il gene di una particolare proteina.
La nuova tecnica 3DISCO – dall’inglese 3D imaging of solvent cleared organs- sta rivoluzionando lo studio delle connessioni neuronali. Infatti, permette di acquisire in poche ore immagini ad alta risoluzione di interi organi, inclusi cervello, midollo spinale , polmoni, ghiandole mammarie e tumori [4].
Tessuti e cellule utilizzabili
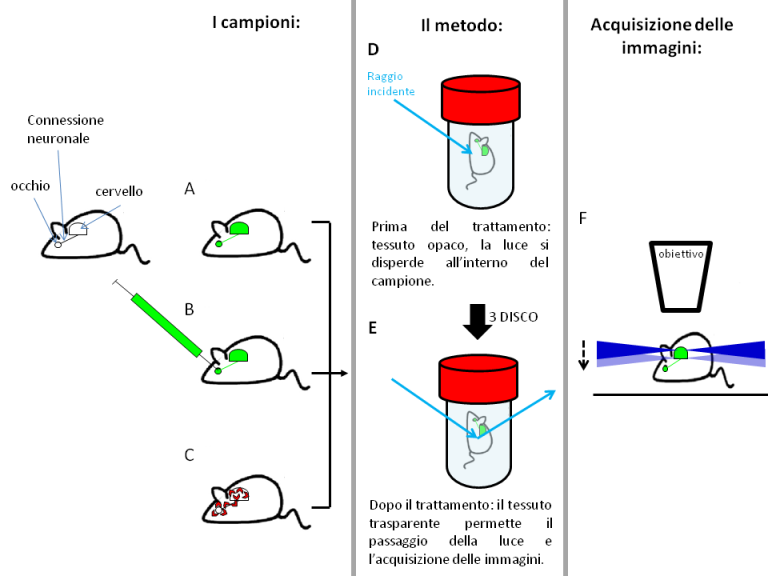
Questa tecnica è compatibile con diverse proteine fluorescenti (ad esempio la proteina fluorescente verde Green Fluorescent Protein o GFP e le sue varianti in altri colori, come ad esempio la rossa Red Fluorescent Protein o RFP). La 3DISCO può essere utilizzata con topi geneticamente modificati per produrre proteine fluorescenti come la GFP solo in alcuni tipi di neuroni (Figura 19A). Diversi marcatori, attaccati chimicamente a diverse proteine fluorescenti (con colori diversi) possono essere usati allo stesso tempo per identificare tessuti diversi all’interno dell’organismo con colorazioni ben distinte. Ad esempio, nel midollo spinale di roditore adulto, marcando le cellule gliali con una proteina fluorescente di un colore ed i neuroni con un altro colore, è stato possibile visualizzare allo stesso tempo l’attivazione gliale e la rigenerazione dei neuroni in seguito a lesione del midollo spinale [5]. Il metodo più utilizzato per la marcatura delle connessioni neuronali tra l’occhio ed il cervello prevede l’iniezione di un composto fluorescente (chiamato CTB) all’interno dell’occhio. Una volta iniettato, questo composto viene trasportato dal corpo cellulare del neurone (situato nella retina) verso l’assone, che mette in comunicazione l’occhio con specifiche aree del cervello. Tramite trattamento 3DISCO è così possibile visualizzare nel cervello di topo adulto le connessioni neuronali con le aree del cervello coinvolte nella risposta agli stimoli visivi (cioè il talamo e il mesencefalo ) (Figura 19B e Figura 20).
Più recentemente è stato dimostrato che questo metodo è anche compatibile con marcatura utilizzando anticorpi fluorescenti [6]. L’utilizzo degli anticorpi è molto vantaggioso dal momento che non sempre è possibile modificare geneticamente degli organismi modello introducendo proteine fluorescenti che permettano di individuare specifiche cellule. L’utilizzo di anticorpi , invece, permette di marcare un qualsiasi tipo cellulare, semplicemente avendo a disposizione un anticorpo specifico e, ad oggi, diverse aziende commercializzano anticorpi in grado di riconoscere qualsiasi proteina. (Figura 19C).
Il metodo
Questa tecnica si basa sull’utilizzo di tre diversi solventi organici. Il tessuto viene innanzi tutto disidratato con soluzioni di tetraidrofluorano (THF). Questa fase è seguita da un trattamento a base di diclorometano che dissolve i lipidi , principalicostituenti delle membrane cellulari. L’eliminazione dei lipidi permette di mantenere intatta la struttura delle cellule, privandole solo della componente lipidica che ostacola fortemente il passaggio della luce attraverso il campione. Alla fine del processo il tessuto diventa così trasparente, permettendo quindi il passaggio della luce e l’acquisizione di immagini di tessuti interi, spessi anche diversi millimetri (fino a 1.5/2 cm) (Figura 19D).
L’acquisizione delle immagini
L’analisi avviene tramite ultramicroscopio a fluorescenza, in cui il campione è scannerizzato da un “foglio di luce”, ossia un particolare microscopio ottico in cui il campione viene scansionato da un sottilissimo piano di luce laser invece che da un singolo raggio. Questa tecnica permette di scansionare il campione e di acquisirne consecutivamente diversi piani come se si trattasse di sezioni separate. Questi piani possono poi essere allineati a formare immagini tridimensionali. Sebbene possa apparire molto complessa, questa tecnica di microscopia è molto meno costosa rispetto alla più tradizionale microscopia confocale (il prezzo di un microscopio a fluorescenza è almeno la metà di quello di un confocale) (Figura 19E). Il basso costo sta rendendo questa tecnica facilmenteaccessibile a molti laboratori di ricerca. Le immagini possono essere acquisite anche utilizzando un microscopio confocale (vedi Box), ma in questo caso la più alta risoluzione limita lo spessore massimo del campione che può essere analizzato, facendo di fatto perdere una parte dei benefici della 3DISCO.
Tecniche di imaging
Tecniche istologiche. L’analisi istologica di tessuti prevede innanzi tutto la “fissazione” del campione, ovvero il tessuto (ad esempio cervello di topo, organi, occhi,…) viene trattato con una soluzione che crea dei legami chimici tra le proteine all’interno della cellula, evitando in questo modo il deterioramento del tessuto. Successivamente, il tessuto può essere incluso in qualche resina al fine di renderlo rigido e quindi permettere il taglio in sottili sezioni di qualche micrometro di spessore (ad esempio, un occhio può essere tagliato anche in sezioni di una decina di micrometri) con strumenti specifici. Le sezioni vengono poi deposte su vetrini e quindi trattate con coloranti chimici che, interagendo con le strutture cellulari, le rendano visibili al microscopio. Oppure, molto utilizzata nel campo della ricerca, è l’immunoistochimica, in cui le sezioni sono trattate con anticorpi . Un anticorpo riconosce una molecola specifica (definita antigene), od una porzione di essa, espressa dalla cellula. L’anticorpo può essere legato ad una molecola fluorescente, permettendo di visualizzare le sezioni al microscopio a fluorescenza.
Microscopia a fluorescenza. Nata nel secolo scorso e perfezionata nel corso degli anni, la microscopia a fluorescenza è diventata uno strumento di indagine biologica indispensabile. I campioni vengono marcati con sostanze chimiche fluorescenti (un esempio è il DAPI che si lega al DNA, rendendo fluorescente il nucleo della cellula) o con anticorpi legati a molecole fluorescenti. Durante l’osservazione al microscopio, il campione viene colpito da un raggio di luce (che viene definito raggio incidente). Il raggio di luce è energia che, colpendo le molecole fluorescenti nel campione, le eccita, facendole passare da uno stato energetico ad un altro. Quando le molecole si “rilassano”, ovvero tornano al loro stato energetico di riposo, emettono energia sottoforma di luce. Questa luce viene raccolta dal microscopio e “trasformata” in immagini.
Microscopia a due fotoni. Diversamente dalla microscopia a fluorescenza comunemente utilizzata, con la microscopia a due fotoni il fluoroforo (la molecola fluorescente) viene eccitato contemporaneamente da due fotoni (“particelle di luce”). L’energia del singolo fotone non è in grado di eccitare il fluoroforo, ma solo la somma delle energie dei due fotoni sarà sufficiente ad eccitare la molecola fluorescente. Ciò costituisce un vantaggio rispetto alla classica microscopia confocale, per due motivi fondamentali. Dato che la probabilità che due fotoni eccitino due molecole su diversi piani focali è praticamente inesistente rispetto alla probabilità che eccitino entrambi una molecola sullo stesso piano focale, il segnale derivante da altri piani focali, che generalmente influenza l’immagine raccolta, è trascurabile (nel microscopio confocale classico questa è eliminata utilizzando un “pinhole” che “seleziona” la luce raccolta da uno specifico piano focale). Inoltre, dato che solo in un punto specifico del tessuto la molecola riceverà energia sufficiente ad essere eccitata, il tessuto circostante non verrà influenzato, limitando cosi la tossicità indotta dalla stimolazione luminosa (fototossicità). Ciò la rende una tecnica largamente utilizzata in vivo.
Microscopio a foglio di luce. Microscopio ottico in cui il campione viene scansionato da un foglio di luce laser invece che da un singolo raggio, permettendo di acquisire diversi piani di un certo campione che possono essere successivamente allineati a formare immagini tridimensionali.
Microscopio confocale. Microscopio ottico che permette di acquisire immagini a più alta risoluzione, grazie ad una tecnologia che elimina la luce diffusa dal campione stesso.
MRI- Imaging a Risonanza Magnetica. E’ una tecnica di indagine medica che si basa sulle proprietà magnetiche degli atomi che compongono i tessuti biologici. Ogni atomo possiede un piccolo campo magnetico. Quando viene applicato un campo magnetico esterno, tutti i campi magnetici degli atomi che compongono il tessuto biologico si allineano al campo magnetico applicato. A questo punto, se vengono applicate delle radiofrequenze, queste interferiscono con il campo magnetico degli atomi (ogni tipo di atomo risponde in modo diverso alla radiofrequenza). Quando la fonte di radiofrequenze viene spenta, l’asse magnetico dell’atomo ritorna alla sua condizione iniziale di “riposo”, e l’energia emessa viene utilizzata per creare delle immagini. Le diverse immagini raccolte dipendono dalla composizione in atomi delle diverse porzioni di tessuto analizzate con l’MRI.

Attraverso programmi avanzati di calcolo e manipolazione delle immagini, i dati raccolti possono essere sfruttati per creare modelli tridimensionali ad alta risoluzione (Figura 20).
Questo video (Link, Fonte: [7]) mostra la ricostruzione tridimensionale di una sezione di midollo spinale di un embrione di topo modificato geneticamente per esprimere la proteina GFP. E’ possibile vedere gli assoni dei neuroni sensoriali, che raccolgono le informazioni sensoriali portandole al sistema nervoso, e le zone in cui le fibre nervose entrano nel midollo spinale (le due “linee parallele” che si vedono nel video).
Applicazioni e benefici
Gli utilizzi di questa tecnica nel campo della ricerca biologica sono molteplici. La rapidità di preparazione dei campioni la rende ad esempio uno strumento utilissimo per analizzare velocemente gli effetti di alcune mutazioni sulla formazione delle connessioni neuronali durante lo sviluppo, permettendo l’individuazione di eventuali disturbi del sistema nervoso. Inoltre, può essere utilizzata per visualizzare i danni dovuti a specifiche malattie neurologiche. D’altronde, l’utilizzo di 3DISCO non è limitato allo studio di disturbi dello sviluppo. Infatti, si è dimostrata molto utile nello studio degli effetti indotti da lesioni a livello del sistema nervoso [8]. L’incidenza delle lesioni del midollo spinale è di circa 20/40 casi per milione di abitanti, all’anno. Solo la possibilità di studiare in vivo ed analizzare il comportamento delle cellule “nel loro ambiente”, analizzando la risposta di un organismo ad uno stress di tale entità, ha permesso di identificare e testare alcune molecole molto promettenti nella rigenerazione degli assoni del midollo spinale [9], un campo in cui purtroppo la ricerca non ha ancora trovato una risposta efficace. L’utilizzo di 3DISCO è in grado di semplificare lo studio dettagliato del problema al fine di trovare una risposta utile ed in futuro una terapia efficace.. Tutto ciò sta velocemente rendendo 3DISCO uno strumento molto apprezzato dai neuroscienziati, contribuendo alla sua veloce diffusione.
Autore: Stefania Averaimo
Stefania si è laureata in Scienze Biologiche nel 2006 all'Università Sapienza di Roma. Ha proseguito gli studi con una laurea specialistica all'Università degli Studi di Milano, cominciando sin dall'inizio ad interessarsi alle neuroscienze. Durante il dottorato di ricerca in Scienze Fisiologiche e Morfologiche all'Università di Milano, ha avuto l'opportunità di lavorare un anno negli Stati Uniti, alla Virginia Commonwealth University di Richmond, e all'Istituto Italiano di Tecnologia di Genova. La sua tesi di dottorato riguardava il ruolo di un canale ionico di cloro regolato dal cAMP nella crescita assonale delle cellule gangliari della retina; studi per i quali ha ottenuto un Mark Smith Award. Dopo il dottorato si è trasferita a Parigi per un post doc presso l'Institut de la Vision, con una borsa della Fondation de France, focalizzando le sue ricerche sul ruolo dei lipid rafts nella segregazione di diversi segnali di cAMP durante la rifinitura delle connessioni neuronali delle cellule gangliari della retina.